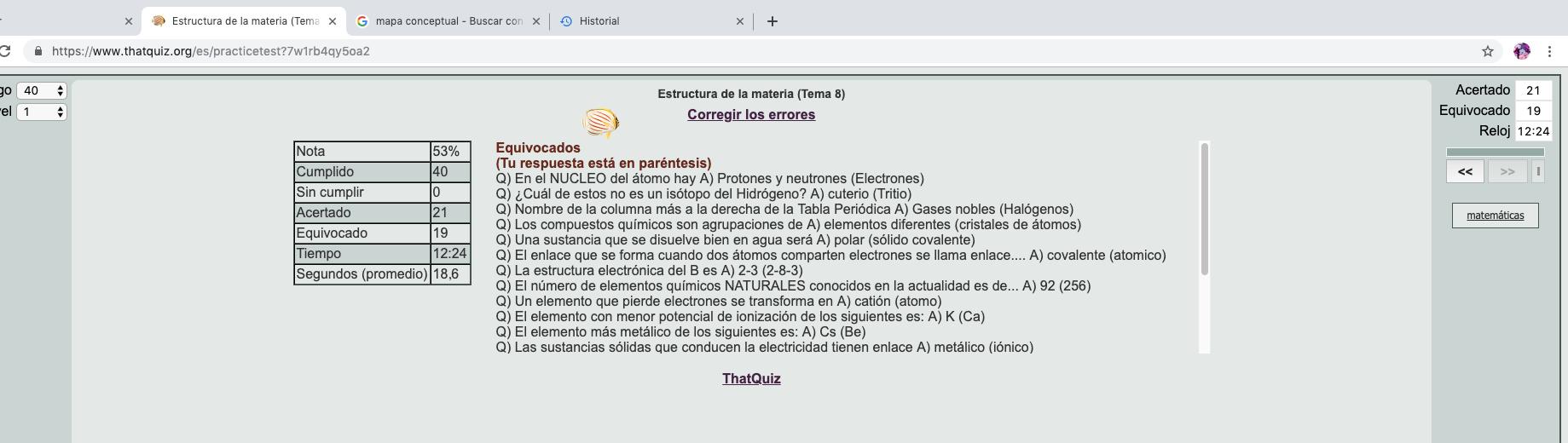
los elementos podían colocarse en filas horizontales en orden ascendente según su peso atómico, y en columnas verticales según sus características químicas... dejando huecos allí donde las pautas parecían requerirlos. Publicó estas ideas en un escrito titulado Relación entre las propiedades de los elementos y su peso atómico. Este contenía su ley periódica, que señalaba que si los elementos conocidos se listaran según un orden de peso atómico ascendente:
- Mostrarían una pauta repetitiva de valencias ascendentes y descendentes (la proporción en que se combinan con otros elementos).
- Formarían grupos que muestran una pauta recurrente de otras características.
Una consecuencia del descubrimiento de Mendeleyev fue que pudo recolocar 17 elementos en la tabla basándose en sus propiedades químicas, implicando que sus pesos atómicos aceptados eran incorrectos. También fue capaz, gracias a los huecos de su tabla, de postular la existencia de tres elementos hasta entonces desconocidos e incluso prever sus propiedades.
La reacción inicial al escrito de Mendeleyev fue tan precavida como la que habían recibido los anteriores intentos de ordenar los elementos, pero cuando se descubrió que los pesos atómico s aceptados de algunos elementos eran realmente incorrectos, sus ideas comenzaron a ser tomadas en serio. Y quince años después, los tres huecos de su tabla se rellenaron gracias al descubrimiento del galio (1875), el escandio (1879) y el germanio (1886), y todos ellos poseían las características que había predicho. Aunque no fue el primero en sugerir que era posible colocar los elementos en un orden que mostrara su periodicidad, Mendeleyev, a diferencia de sus predecesores, demostró que había una lógica subyacente que dictaba su tabla.
También contiene 109 elementos, comparados con los 63 que él conocía. Pero su tabla sigue siendo reconocible porque descubrió la relación fundamental entre los elementos, aunque no tenía la más mínima idea de cómo se unían sus átomos.
Los elementos del 1 (
hidrógeno) al 92 (
uranio) son naturales, ingredientes básicos de los que está hecho el mundo, el resto es creación del hombre. Todos los elementos están formados por unas partículas elementales sumamente pequeñas llamadas protones, neutrones y electrones. Todos los átomos de todos los elementos tienen un núcleo compuesto de protones y neutrones, y alrededor de éste giran los electrones como los planetas giran alrededor del Sol. Así como el Sol contiene la mayoría de la masa del sistema solar, el núcleo contiene la mayoría de la masa del átomo. Y así como los planetas están separados del Sol por inmensos espacios vacíos, las órbitas de los electrones están separadas del núcleo central por inmensos espacios vacíos. Lo que determina el peso atómico de un elemento es el número de neutrones y protones que contiene el núcleo (un protón pesa 1,836 veces más que un electrón), pero son el número y la disposición de los electrones los que determinan las propiedades químicas de un elemento, porque cuando los átomos se combinan, los que se unen son sus electrones.
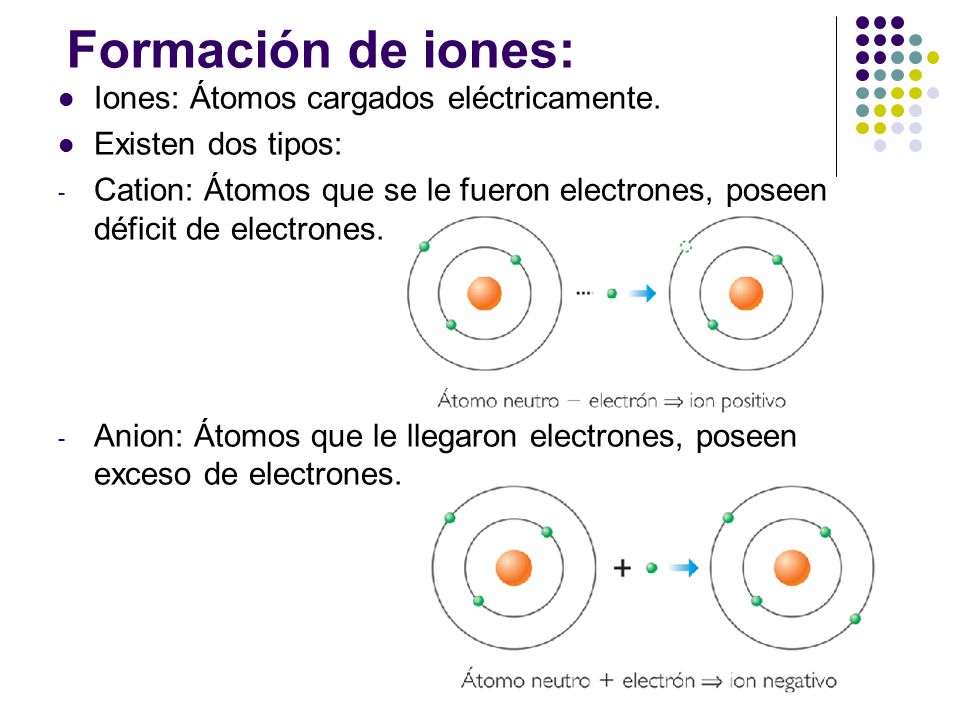
Los números de la tabla periódica son números atómicos y representan el número de protones del núcleo. También corresponden al número de electrones que giran en torno al núcleo, porque cada átomo contiene el mismo número de protones que de electrones. Los electrones tienen una carga negativa, que es equilibrada por la carga positiva de los protones. El peso atómico de un elemento depende del número total de protones y neutrones en el núcleo, y tiende a aumentar a medida que crece el número atómico, pero algunos elementos tienen versiones múltiples, los llamados
isótopos. Por ejemplo, el uranio natural (de número atómico 92) tiene dos versiones: el
uranio 235, con 92 protones y 143 neutrones, por tanto con un peso atómico de 235; y el uranio 238, con 92 protones y 146 neutrones, y un peso atómico de 238 (igual a 238 átomos de hidrógeno).
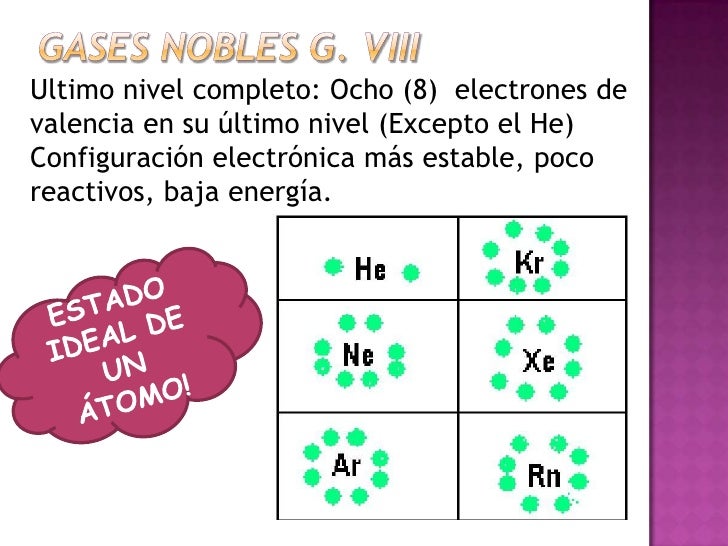
Las columnas verticales son llamadas «grupos»: son familias de elementos con propiedades similares. Así, la columna de la derecha contiene los gases «nobles» o «inertes»: el helio, el neón, etc. También suelen ser llamados gases «perezosos» (argos es «perezoso» en griego), porque son lentos para combinarse con otros elementos. Esto los hace útiles para llenar globos aerostáticos (el helio es más seguro que el hidrógeno) y lámparas fluorescentes (el argón).
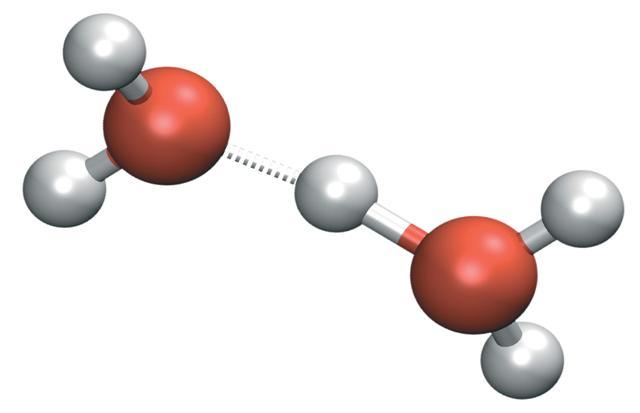
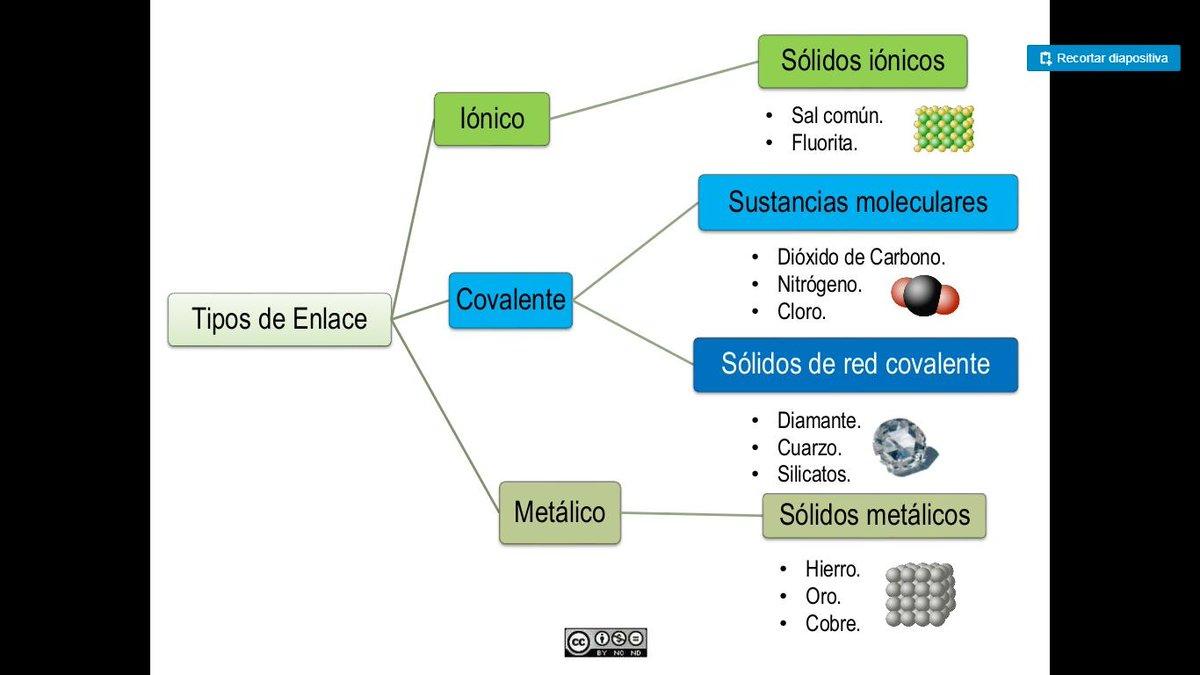
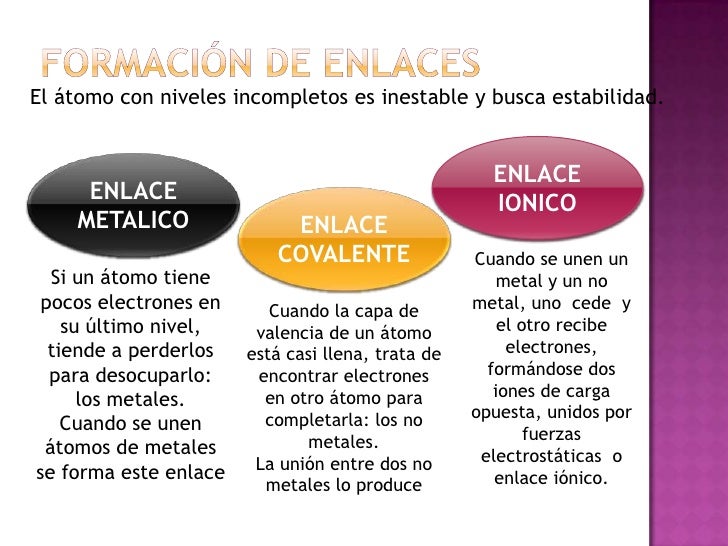 Estructura de la molécula en la que los electrones de valencia se representan como puntos situados entre los átomos enlazados, de forma que un par de puntos representa un enlace covalente simple (generalmente se representa por una línea). Un enlace doble se representa por dos pares de puntos, etc. Los puntos que representan electrones de no enlace se colocan adyacentes a los átomos a los que están asociados, pero no entre átomos. Se asignan cargas formales (+, -, 2+, etc.) a los átomos para indicar la diferencia entre la carga nuclear positiva (número atómico) y el número total de electrones (sobre la base formal de que los electrones de un enlace están compartidos igualmente entre los átomos que enlazan
Estructura de la molécula en la que los electrones de valencia se representan como puntos situados entre los átomos enlazados, de forma que un par de puntos representa un enlace covalente simple (generalmente se representa por una línea). Un enlace doble se representa por dos pares de puntos, etc. Los puntos que representan electrones de no enlace se colocan adyacentes a los átomos a los que están asociados, pero no entre átomos. Se asignan cargas formales (+, -, 2+, etc.) a los átomos para indicar la diferencia entre la carga nuclear positiva (número atómico) y el número total de electrones (sobre la base formal de que los electrones de un enlace están compartidos igualmente entre los átomos que enlazan