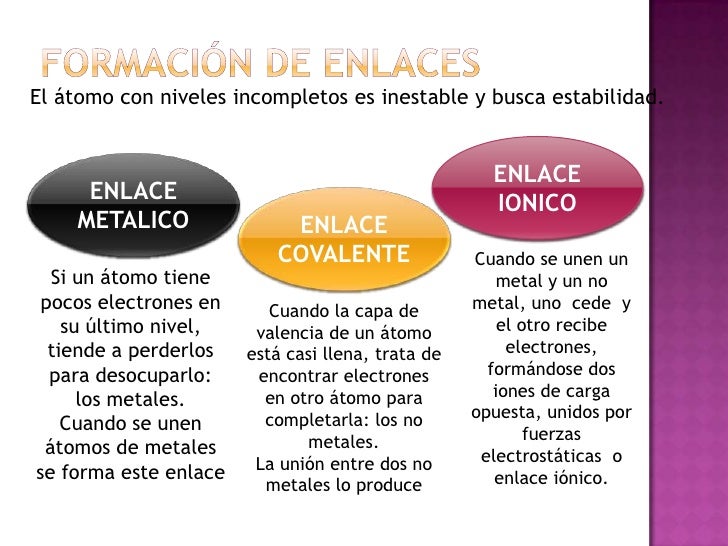
Las estructuras de Lewis muestran los diferentes átomos de una determinada causa usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. Representan también si entre los átomos existen enlaces simples, dobles o triples. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones apartados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
Este modelo fue propuesto por Gilbert Newton Lewis quién lo introdujo por primera vez en 1916 en su artículo La molécula y el
 Estructura de la molécula en la que los electrones de valencia se representan como puntos situados entre los átomos enlazados, de forma que un par de puntos representa un enlace covalente simple (generalmente se representa por una línea). Un enlace doble se representa por dos pares de puntos, etc. Los puntos que representan electrones de no enlace se colocan adyacentes a los átomos a los que están asociados, pero no entre átomos. Se asignan cargas formales (+, -, 2+, etc.) a los átomos para indicar la diferencia entre la carga nuclear positiva (número atómico) y el número total de electrones (sobre la base formal de que los electrones de un enlace están compartidos igualmente entre los átomos que enlazan
Estructura de la molécula en la que los electrones de valencia se representan como puntos situados entre los átomos enlazados, de forma que un par de puntos representa un enlace covalente simple (generalmente se representa por una línea). Un enlace doble se representa por dos pares de puntos, etc. Los puntos que representan electrones de no enlace se colocan adyacentes a los átomos a los que están asociados, pero no entre átomos. Se asignan cargas formales (+, -, 2+, etc.) a los átomos para indicar la diferencia entre la carga nuclear positiva (número atómico) y el número total de electrones (sobre la base formal de que los electrones de un enlace están compartidos igualmente entre los átomos que enlazan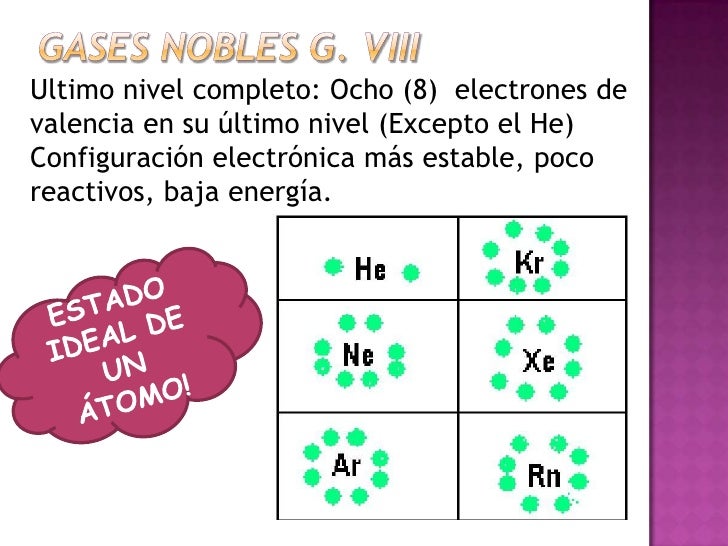
No hay comentarios.:
Publicar un comentario